物質量1(mol)は炭素12gが測れる計量カップ中の炭素原子の個数6.02×10²³(個)
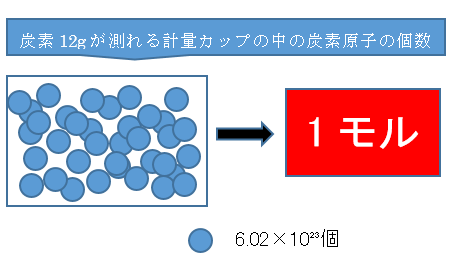
物質量1(mol)は6.02×10²³(個)の粒子の集まりです。
なぜこのような巨大な個数を1モルとして考えるのでしょうか?
それは、原子レベルでものの大きさや重さ、個数を考えると、とても小さすぎて不便だからなのです。
小さなものは、ある程度の量を、「ひとたば」と考えた方が楽ですよね。
例えば鉛筆。
12本を1ダースと数えますよね。
また床に散らばった無数のボールを想像してみてください。
とりあえず片付けるために袋につめましょう。
つめたボールの個数は、「1袋分」と数えますよね??
実際のボールの数を調べると50個くらいだったりします。
つまり「モル」は、ひとまとめにして数えたほうが楽だから、そのように定義するのです。
ではなぜ、炭素原子12gなのでしょうか??
くわしく見ていきましょう。
原子1個の重さ(陽子・中性子・電子)
原子1個の重さは陽子の重さと中性子の重さと電子の重さを足したものです。
陽子1個の重さは1.673×10⁻²⁴gです。
中性子はほぼ同じ重さです。
電子は 陽子の2000分の1の重さなのでほぼ無視できます。
そのため、陽子と中性子の数の合計を 1.673×10⁻²⁴g でかけたものが原子1個の重さになります。
原子の重さは質量数で考えるの便利
原子の重さは陽子と中性子の個数の和で考えるのが便利です。
炭素原子は陽子6個と中性子6個なので質量数は12。
水素原子は陽子1個なので質量数は1。
つまり、質量数で、炭素原子は水素の12倍の重さだと簡単にイメージできます。
炭素12gは一体何個の粒子??
日常生活は1g単位が基本です。
最も身の回りで重要な炭素原子12gは一体何個の原子粒子があるんだろう?と考えると(なぜ12gで考えるのかは、炭素原子の質量数は12なので)
炭素1原子の重さは、陽子6個と中性子6個の重さですから、12× 1.673×10⁻²⁴(g )くらいです。(厳密には陽子と中性子は若干重さが違いますから違います)
$$\frac{ 12(g) }{ 12・1.673・10⁻²⁴(g) }=\frac{ 10²⁴ }{ 1.673 }(個)≒6×10²³(個) $$
毎回毎回、6×10²³個なんて考えてたら不便です。
炭素は質量数が12なので、12gを1モルとした
炭素は質量数が12なので、12gを1モルとしました。
そうすると質量数1の水素が1モルあれば、1gですし、質量数2のヘリウムが1モルあれば、2gです。
つまり質量数にモル数をかければ、簡単にgが分かるようにできているのです。





