原子の形 分子か分子以外か
希ガス以外の元素は、原子のままではなく
分子か分子以外か
で存在します。
希ガス以外の元素は原子のままでは不安定(くっつきやすい、バリアーが弱い)なので、分子か分子以外の形で、他の原子とくっついて存在しています。
では分子と分子以外の形とは、どのようなものなのかを見ていきましょう。
分子とは?
分子とは、数えられる程度の原子と原子がくっついた状態です。
1個の原子と1個の原子がくっついたり
1個の原子と2個の原子がくっついたり
その程度のくっつきです。
ですのでまだまだ小さいことが多い(気体)ですが、ある程度大きくなることもあります(液体)。
ではどのようにくっついているのでしょうか?
分子のくっつきは「共有結合」
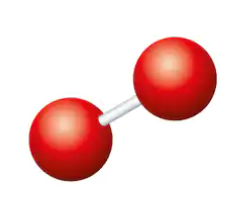
分子のくっつきは共有結合といいます。
共有結合は、最外殻電子が、他の原子の最外殻電子軌道にあやまってはいってしまい、弾き飛ばされず受け入れられた状態です。
価電子数が0になって初めて、弾き飛ばされるようになります。
(つまり希ガスの状態を原子は目指す、というわけです。)
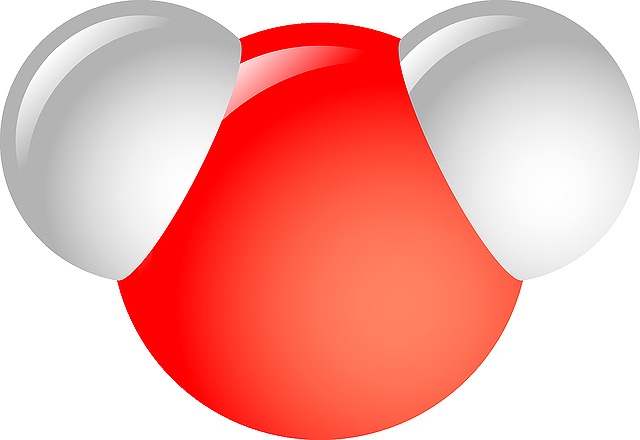
ここで酸素原子Oについて考えてみましょう。
酸素原子はK(2)L(6)です。価電子数は6。
希ガスの状態になるまであと2つ足りません。
(毎回毎回、「希ガスの状態」、というのも面倒なので「閉殻」という言葉を覚えましょう。
最外殻電子軌道がいっぱいの状態を「閉殻」といいます。)
酸素原子同士が2つの電子を同じ軌道に共有することで、8個の状態に近づくことができます。
電子を共有して結合するため、共有結合といいます。
分子以外とは??
原子は必ずしも分子の形では存在しません。
分子以外の形には、以下の3つがあります。
①共有結合結晶
②金属結晶
③イオン結晶
一つずつ見ていきましょう。
①共有結合結晶
分子と同じ共有結合なのですが、数えられないくらいの原子が結合して、結晶となります。(合体しすぎて大きくなり、目に見える)
代表的なものは炭素原子C (K(2)L(4))です。
C原子は、価電子が4つなので正四面体様に、電子を共有しようとします。結合する相手のC原子も、他のC原子と正四面体様に結合しますので、数えられないくらいの原子と結合して、おおきくなりすぎて結晶化するわけです。
(はじっこは、C原子以外の原子と結合して存在しています。)
共有結合を繰り返して結晶化しているので、「共有結合結晶」というわけです。
②金属結晶

金属結晶は、その名の通り金属です。
金属の特徴は価電子が少ないこと。
例えばナトリウム原子(Na)(K(2)L(8)M(1))を考えましょう。
価電子はM殻の1個ですね。
この場合はどこかと電子を共有するより、あげてしまった方が閉殻に近づきます。
そのため原子同士でパスし合うのです。
パスされた電子は、金属表面を一瞬にして流れていき、ずっとパスが続いている状態です。(そのため電気を通すのです)
パスされた電子が、バリアーの役目を果たしている不思議な状態なのです。
この電子のパスの仕合いは、あらゆる方向で起きますので、合体が大きくなり、結晶化(目に見える)わけです。
③イオン結晶
ナトリウム原子Na(K(2)L(8)M(1))と塩素原子Cl(K(2)M(8)N(7))を考えましょう。
Naは電子が1個パスしたい
Clは電子を1個欲しい
需要と供給がマッチして
Naは電子を1個Clにあげるのです。
あげた瞬間にNaはプラスに帯電(マイナスの電荷をもつ電子1つを失うため電子に対して陽子が1つ多くなるから)し、Clはマイナスに帯電します。
プラスに帯電したNaと、マイナスに帯電したClはお互いに強くひきつけ合います。
また、プラスに帯電したNaは、いろいろな方向のマイナスを帯びたClをひきつけ合うので、巨大に合体するのです。
この結合の様子を「イオン結合」といいます。