さぁ、本日から理論化学超特急丸わかり講座が始まります!
コロナウイルスの影響で塾や学校に行けず、勉強に困っている方の一助となれば幸いです。
本日は第1回目「化学とは??」
化学とは元素の追及。正体は原子
化学とは「もの」を近くから見た様子を勉強する学問です。
なにも難しいことはなく、「ただ近くからものを見ればいいのです。」
ですが。。。
この「近く」。
もんのすごい近づきます…
どのくらい近づくのか??
「もの」が小さな粒々でできていることが分かる距離まで近づきます。。。
もちろん、人間の目でそこまでは見ることができませんので、特殊な虫眼鏡(特殊顕微鏡)で観察します。
化学に限らず、すべての学問は、「ものを観察して分かったことを記録していった全人類の日記」です。
ただし、違うのはものを観察するときの「距離」です。
物理は化学よりちょっと離れて観察して分かったことを記した日記です。
歴史は、さらにもっと遠くから離れて(時空を超えて)観察した日記です。
観察するときの「距離」で、「もの」はまるで別のもののように見えます。
これは皆さんご存知のはずです。
飛行機にのったときのことを思い出してみてください。
飛行機がどんどん空に向かって飛んでいくに連れて、窓からみた様子は変わっていきます。
あれだけ大きかった自動車は豆粒のようになり。
飛行機から見える海の波の様子はまるで止まっているように見え。
つまりものの様子は「観察する距離」で違って見えるのですね。
「もの」は何からできている??
ものすごい近くから観察しても、「もの」が何からできているか、昔はよく分かりませんでした。
観察する虫眼鏡が限界があったからです。
よく分からないけど、「もの」は共通の何かからできているに違いない!
と考えられてきました。
「もの」の成分を「元素」と呼ぶ
その「何か」はよく分からないので、とりあえずその何かを「元素」と呼ぶことにしました。
元素はいっぱいある。
元素はいっぱいあります。
水素(H)、ヘリウム(He)、リチウム(Li)、ベリリウム(Be)、ホウ素(B)、炭素(C)、窒素(N)、酸素(O)、フッ素(F)、ネオン(Ne)、ナトリウム(Na)、マグネシウム(Mg)、アルミニウム(Al)、ケイ素(Si)、リン(P)、塩素(Cl)、アルゴン(Ar)、カリウム(K)、カルシウム(Ca)。
他にもあるのですが、今あげたものは全部覚えねばなりませぬ。。。
覚え方がありますのでご紹介しましょう。
水平リーベー、僕の船、名前がある、シップスクラークか?
何度もこの呪文を繰り返し唱えると、そこまで大変ではありませんのでご安心くださいね。
「元素」の正体は原子!
元素の正体は原子です。
時は流れ、観察する虫眼鏡がどんどん進化し、顕微鏡が発明され、技術の進歩でものすごい細かいところまで拡大して見えるようになり、やっと「元素」の正体が「原子」だと分かったのです。
原子の「原」の部首は、 「厂(がんだれ)」。
「がけ」を意味します。
「崖にある泉」のように「湧きはじめた源」というイメージです。
「子」は子供⇒卵⇒粒子のようなイメージです。
すべての物質は「原子」からできていますが、まさにイメージ通りの名前ですね!
原子はどんなものなの??
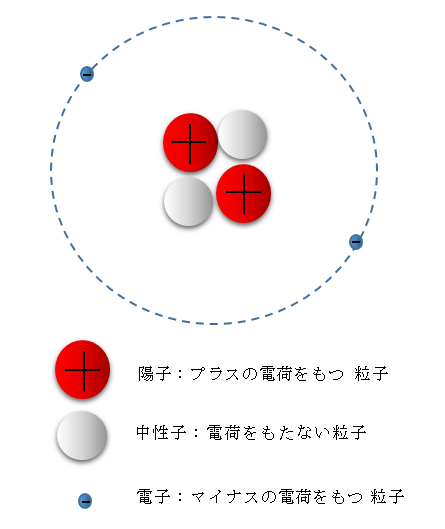
原子は中央にある原子核と、その外側を飛び回る電子でできている。
原子は中央にある原子核と、その外側を飛び回る電子でできています。
原子核には「陽子」というプラスの電荷をもった粒子が陣取っています。
原子核の外側をマイナスの電荷をもった粒子「電子」が飛び回っています。
原子の違いは「陽子の数」
原子の違いは陽子の数です。
陽子が1個⇒水素原子
陽子が2個⇒ヘリウム原子
さきほど覚えた「水平リーベー~」の順に1個ずつ陽子が増えていきます。
陽子は1個そのものが太陽のようなイメージです。
太陽が1つある宇宙は、太陽が2つある宇宙とまるで違いそうですよね?
そのため、陽子の数が違うと、まるで性質が違う「別物」になるわけです。
陽子の数が原子番号
陽子の数を原子番号といいます。
陽子の数で、原子が決まるので、背番号のようなものをあてがうイメージです。
電子の数と陽子の数は一緒
電子の数と陽子の数は一緒です。
原子核にある陽子のプラスの電荷分だけ、電子は引き付けられ、外側をぐるぐる飛び回るからです。
陽子は2個以上だと中性子が必要
陽子は2個以上だと原子核に「中性子」という粒子が必要です。
中性子は電荷をもたない粒子ですが、陽子同士が反発しないようにがっちりくっつける力「核力」をもっています。
陽子が1個の水素原子は中性子はありませんが、2個以上だと、基本的には陽子の数だけ中性子が必要です。
外側の電子のおかげで、原子同士が結び付いたり、ぶつかったりする
外側の電子のおかげで、原子同士が結びついたり、ぶつかったりします。
ものとものはぶつかりますが、実は外側を飛び回っている電子と電子がぶつかっているのです。
もし電子と電子がぶつからなかったら、そのまま「ものともの」はスッっとすりぬけてしまうでしょう。
もしかすると「幽霊」は電子がない「もの」なのかも知れませんね…
最も外側の電子の数は「最外殻電子数」
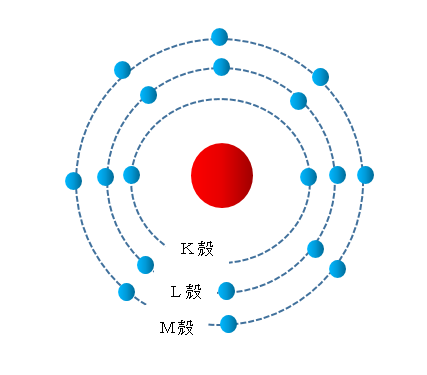
外側の電子の数を「最外殻電子数」といいます。
実は、これは、陽子の数と一緒ではありません。
全部の電子数は確かに、陽子の数と一緒なのですが、最外殻電子数は
「最外殻」
つまり、一番外側にある電子の数を考えなければならないからです。
電子は数がある程度以上まで増えると、同じ軌道にある電子とぶつかってしまうので、弾き飛ばされて、外側の軌道を飛び回るようになります。
1つの軌道には、通常8個まで、電子が飛び回れます。
しかし、原子核に一番近い軌道は例外です。
とても小さい軌道になるので2個までしか飛び回れません。
イス取りゲームを想像してくださいね。
(イスの数が少なくなるほどイスのサークルは小さくなり、周れる人も少ないですよね?)
一番内側の軌道を「K殻」といいます。
外側になるにつれてL殻、M殻、N殻…とアルファベット順に名前がついています。
K殻に2個の電子がある様子を
K(2)
と表します。
K(2)L(8)M(8)N(2)は何の原子でしょうか??
電子の数⇒2+8+8+2=20⇒原子番号20 陽子の数20個 つまりカルシウムですね?(分からなかった人は「水平リーベー~」を10回唱えながら元素記号を書く練習をしましょう。)
このカルシウムの全部の電子数は20個ですが、最外殻電子数は2個になります。(最外殻はN殻)
最外殻電子数が一緒だと原子の性質が似る
最外殻電子数が一緒だと、原子の性質が似ます。
原子と原子を結び付けたり、ぶつかたっりするのは最外殻電子の役割なので、似るのは当然ですね。
原子を結び付けやすい最外殻電子数を価電子という。
原子を結び付けやすい最外殻電子数を価電子といいます。
K(2)L(8)M(2)のマグネシウムを考えましょう。
マグネシウムの価電子数は2です
M殻を飛びまわる電子数は2個ですが、この2個の電子は間違ってほかのマグネシウムの軌道に入って受け入れられてしまう(弾かれない)のです。
ではK(2)L(8)のネオンはどうでしょうか??
ネオンの価電子数は8ではありません。0です。
なぜなら、最外殻にあるL殻の8個の電子は受け入れるスペースがありません。
あやまって、軌道に入ろうとする電子を弾き飛ばします。
そのため価電子数は0なのですね。
価電子数が0のものは、バリアーがしっかりしている
価電子数が0のものはバリアーがしっかりしています。
他の原子がもつ電子があやまって軌道に入ろうとしてもすぐ、はじきとばすのですね。
これはつまり、他の原子とくっつかないということです。
価電子が0のものを「希ガス」という
価電子数が0のものは、気体として存在するので「希ガス」といいます。
価電子が0のものは
ヘリウム(He:K(2))、ネオン(Ne:K(2)L(8))、アルゴン(Ar:K(2)L(8)M(8))ですね。
これらは1つの原子で非常に安定しています。(ほかの原子とくっつかない)
当たり前ですが、原子はくっつけば、くっつくほど、どんどん大きくなります。(合体ロボットも合体するたびに大きくなりますよね?)
逆に、くっつかないものは、とても小さいです。
つまり価電子は0のものは、くっつかないので、とても小さいです。
小さすぎて目に見えないものを私たちは「気体」と呼んでいます。
そのため「希ガス」は気体なのですね。
原子は希ガス以外は他の原子とくっついていて、原子粒子のままではない。
原子は希ガス以外は基本的に他の原子とくっついて存在しています。
理由はもうお分かりですね?
希ガス以外は、価電子が0ではありませんから、バリアーが不十分です。
バリアーが不十分で、他の原子がもつ電子をすぐに受け入れてします(合体)からですね。
逆に、希ガスは、バリアーがしっかりしており、原子のまま存在できるのです。
次回は原子のままでは存在できない元素を解説していきます。
お楽しみに。





